洁净度99.99
服务范围全国
服务方式上门检测
类型认证检测
价格面议
广州市微生物研究所有限公司经过几十年的发展,本中心已建成为一个集产品检测、技术研发、标准制定、学术交流、人才培养、科普教育于一体的综合型检测机构。
申报条件:
1、新开办药品生产企业,药品生产企业新建、改建、扩建药品生产车间或者新增生产剂型的,应当自取得药品生产文件或者经批准正式生产之日起30日内,按照规定向药品监督管理部门申请《药品生产质量管理规范》认证。
2、剂、、国家食品药品监督管理局规定的生物制品药品GMP认证由国家食品药品监督管理局组织认证。
3、除剂、,国家食品药品监督管理局规定的生物制品外其它药品GMP认证由省食品药品监督管理局组织认证。
4、药品生产企业应在《药品GMP证书》有效期届满前6个月,重新申请药品GMP认证。
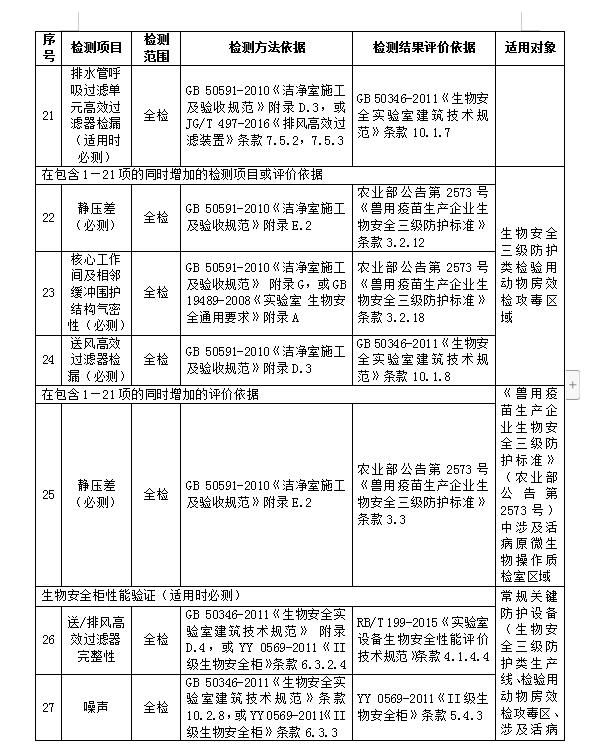
需提交的全部申报材料及数量:
(一)《药品GMP认证申请书》(一式两份)及申请书电子文档。
(二)并附以下相关材料(1份)
1、《药品生产许可证》和营业执照复印件;
2、药品生产管理和质量管理自查情况(包括企业概况及历史沿革情况、生产和质量管理情况,证书期满重新认证企业软、硬件条件的变化情况,前次认证不合格项目的改正情况);
3、企业组织机构图(各部门名称、相互关系、部门负责人);
4、企业负责人、部门负责人简历;依法经过认定的及相关技术人员、工程技术人员、技术工人登记表, 并标明所在部门及岗位;高、中、初级技术人员占全体员工的比例情况表;
5、企业生产范围全部剂型和品种表;申请认证范围剂型和品种表(常年生产品种),包括依据标准、药品批准文号;新药证书及生产批件等有关文件材料的复印件;常年生产品种的质量标准;
6、企业总平面布置图,以及企业周围环境图;仓储平面布置图、质量检验场所平面布置图(含动物室);
7、生产车间概况(包括所在建筑物每层用途和车间的平面布局、建筑面积、洁净区、空气净化系统等情况。其中对β-内酰胺类、避孕药、类、抗类、等的生产区域、空气净化系统及设备情况进行重点描述),设备安装平面布置图(包括更衣室、盥洗间、和物流通道、气闸等,并标明人、物流向和空气洁净度等级);空气净化系统的送风、回风、排风平面布置图;
8、认证剂型或品种的工艺流程图,并主要过程控制点及控制项目;
9、关键工序、主要设备、制水系统及空气净化系统的验证情况;
10检验仪器、仪表、量具、衡器校验情况;
11、企业生产管理、质量管理文件目录;
12、企业符合消防和环保要求的文件;
13、药品委托检验协议及前处理提取委托加工批件的复印件;
14、新开办药品生产企业、药品生产企业新增生产范围申请药品GMP认证,除报送以上资料外,还须报送认证范围涉及品种的批生产记录复印件;
申请企业应当对其申报材料全部内容的真实性负责。以上材料统一用A4纸打印装订成册。

办理程序:
(一)申请:
申请人向省政务大厅食品药品监督管理局窗口提交《药品GMP认证申请书》(一式两份)及申请书电子文档,并附相关材料。
(二)受理:
申请材料经省政务大厅食品药品监督管理局窗口形式审查符合要求的,予以受理,出具受理通知书;申请材料不齐全或者不符合形式审查要求的,5个工作日内发给申请人《补充材料通知书》;不予受理的出具《不予受理通知书》。
(三)现场检查:
经形式审查符合要求的转入技术审查,技术审查符合要求的安排现场检查。技术审查需要补充材料的,一次性书面通知申请企业。企业应在2个月内报送,逾期未报的中止认证工作。
(四)审查:
省食品药品监督管理局对现场检查报告进行审核和审批,符合认证标准的报国家食品药品监督管理局予以公告,公告无异议的,颁发《药品GMP认证审批件》和《药品GMP证书》,公告有异议的,组织调查核实。对不符合药品GMP认证标准要求的,且无法通过限期改正达到标准的,发给《药品GMP认证审批意见》;可以责令企业限期改正的,向被检查企业发整改通知书,整改的时期为6个月。企业在期限内改正完毕,提交改正报告,符合要求的派检查组再次进行现场检查。经再次现场检查,符合药品GMP认证标准,颁发《药品GMP认证审批件》和《药品GMP证书》;仍不符合的,发给《药品GMP认证审批意见》。
药品生产企业被吊销、缴销《药品生产许可证》或者被撤消、注销生产范围的,其相应的《药品GMP证书》由原发证机关收回。

GMP认证应用的行业范围:
1.制药厂
2.器械厂
3.食品GMP厂
4.兽药生产厂
5.实验室
6.细胞实验室
http://ggtest.b2b168.com


